论文作者:张凌烽,指导教师:姜虎林
所属学院:药学院,二级学科:药剂学
01 导师说

组织纤维化是由于器官受损引发过度自愈反应,组织内细胞外基质异常增多和过度沉积的病理过程。纤维结缔组织增生会导致实质细胞减少,持续进展可导致器官结构坏死和功能减退,严重威胁人类生命健康。在全球范围内,组织纤维化是许多疾病致残、致死的主要原因。据统计,全球目前约有10亿纤维化患者,我国组织纤维化患病人数已达到近1.5亿人,组织纤维化引起的死亡人数占总死亡人数比例的45%。而肝脏作为维持人体代谢的重要器官,易受到各类损伤而致病并逐渐演变为肝纤维化,带来巨大的经济与健康负担。因此,加强肝纤维化研究、创新治疗技术具有重大的社会意义与科学价值。
张凌烽在硕士阶段始终聚焦抗肝纤维化智能药物递送系统的构建,在深入研究早中晚期肝纤维化的病理机制与特殊微环境的基础上,先后研发病理屏障突破型与多细胞恶性互作阻断型药物递送系统,为肝纤维化的治疗提供全新策略与手段。硕士毕业后,他选择攻读博士学位,以提高肝纤维化治疗效果为目标,继续努力奋斗。
02 作者说

据统计,全球超过24亿人面临非酒精性脂肪性肝病的风险,每年约有200万人死于肝脏相关疾病,肝硬化和肝癌导致的死亡人数约占全球死亡人数的3.5%。肝纤维化是各类慢性肝病发展的必经阶段,并会逐渐发展为肝癌或肝硬化,其本质是肝脏遭受持续损伤并发生炎症坏死,细胞外基质大量蓄积导致瘢痕组织逐渐取代肝实质。大量研究表明,不同于肝硬化阶段的不可逆性,肝纤维化是动态且可逆的,具有一定的治疗可行性。目前很多药物在临床前研究或临床试验阶段展现了潜在的抗纤维化作用,但是临床应用上仍然缺乏高效可靠的抗纤维化药物,主要是由于肝纤维化病理微环境阻碍病灶部位药物蓄积。因此,迫切需要开发安全高效的抗纤维化药物递送系统。
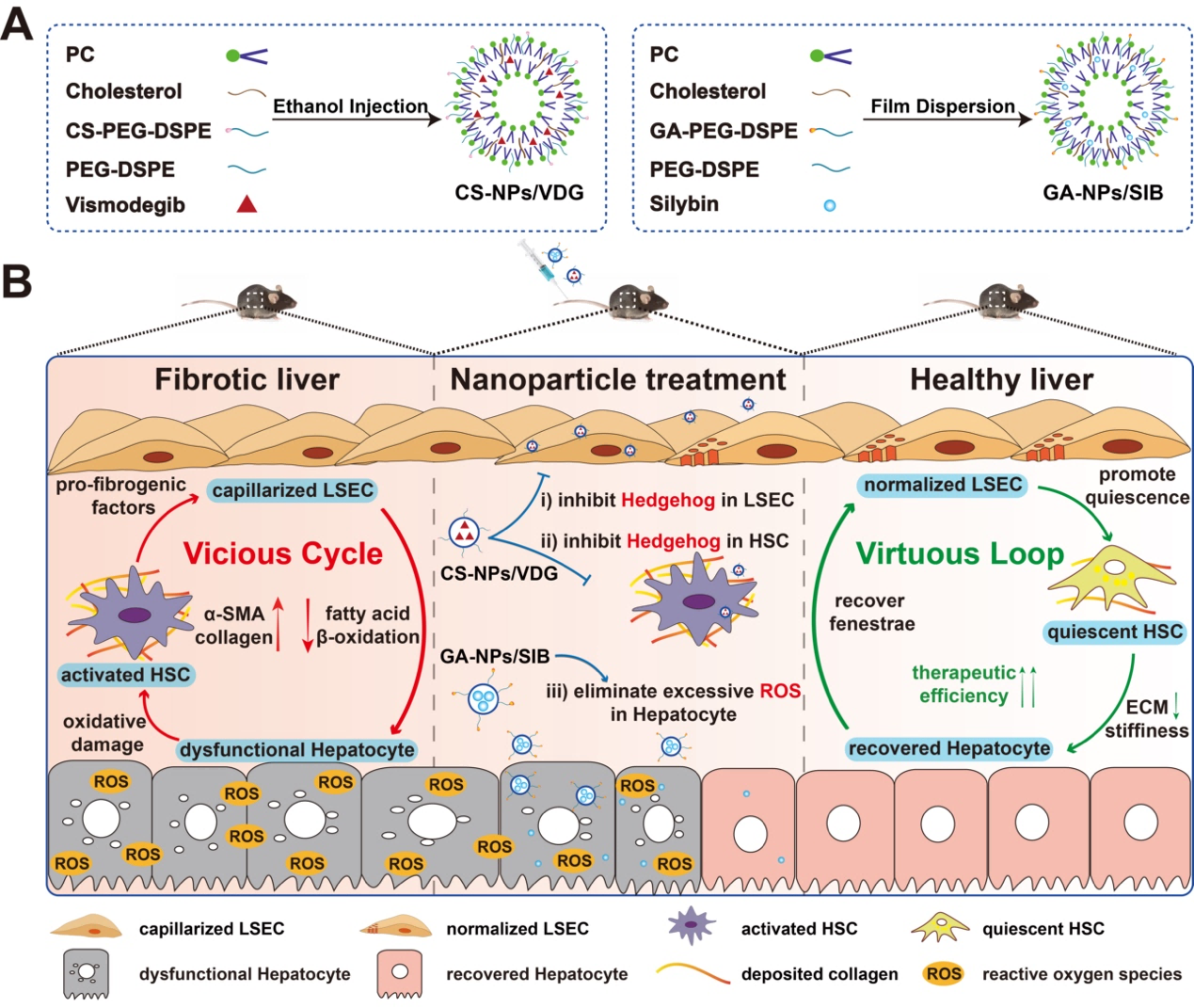
在前期研究中,我们发现在肝纤维化病理微环境下,肝窦内皮细胞发生毛细血管化,失去窗孔并形成基底膜,阻碍物质交换进入Disse腔,成为药物递送的第一道屏障;同时,活化的肝星状细胞分泌大量病理胶原,阻碍了药物的深层渗透,形成第二道屏障,共同阻碍药物向肝星状细胞的递送,构成了双重递送屏障。基于此,我们提出了病理屏障正常化的治疗策略,恢复肝窦窗孔结构并消融沉积胶原,逐级打开双重屏障,有效提高药物在病灶部位的浓度,提高药物疗效,治疗肝纤维化。随着研究的深入,我们发现除了两大递送屏障,在肝纤维化病理微环境中,受损细胞之间通过多种形式相互作用,不断加剧肝纤维化严重程度,削弱了药物疗效。因此,本课题针对肝纤维化受损组织细胞构成恶性循环、加剧纤维化病情这一疾病难点,构建恶性循环逆转型药物递送系统,调控修复多种受损细胞,阻断细胞间恶性作用,逆转恶性循环,恢复生理稳态并促进形成良性循环,为肝纤维化的治疗提出新的治疗策略。
在博士阶段,我会坚持该研究方向,在前期基础上不断深入突破,同时积极联系企业推进相关专利的转化,将基础研究工作真正落在实际应用中。
03 硕士论文简介
肝纤维化是各种慢性肝病向肝硬化和肝癌等严重致死性肝病发展的必经过程,对人类生命健康构成严重威胁。在纤维化肝脏内,毛细血管化的肝窦内皮细胞(LSEC)窗孔丢失,阻碍Disse腔与血液的物质交换,抑制肝实质细胞脂质代谢,加重损伤;受损肝实质细胞凋亡、坏死,氧化应激水平急剧提高,刺激肝星状细胞(HSC)活化;活化的HSC分泌促纤维化因子,反向加剧LSEC毛细血管化。受损细胞之间的恶性互作不断加剧纤维化病情,削弱药物疗效。本文设计硫酸软骨素修饰的包载药物维莫德吉的脂质纳米粒(CS-NPs/VDG)与甘草次酸修饰的包载药物水飞蓟宾的脂质纳米粒(GA-NPs/SIB)。CS-NPs/VDG与LSEC表面高表达的Stabilin 2受体及HSC表面高表达的CD44受体特异性结合,选择性抑制Hedgehog信号通路,恢复LSEC窗孔,并抑制HSC的活化;GA-NPs/SIB与肝实质细胞表面高表达的甘草次酸受体特异性结合,实现高效靶向,减轻损伤并促进细胞再生。两种脂质纳米粒联合治疗,同时调控三类受损细胞,阻断细胞间恶性互作,有效调节病理微环境,逆转肝纤维化,为肝纤维化的有效治疗提供新思路与新方法。
学术成果
张凌烽,现为中国药科大学2023级药剂学博士研究生,主要研究方向为抗肝纤维化智能药物递送系统的构建。共发表SCI论文7篇,累计影响因子108.62,其中以共一第一作者身份在Adv Mater、ACS Nano和Adv Sci发表论文3篇,其中Adv Sci的发表论文被选为封面文章。获授权专利1项,公开专利1项,获得2022年硕士研究生国家奖学金与2024年博士研究生国家奖学金,获得2024年江苏省研究生医药科研创新实践大赛二等奖与2024年首届江苏高校研究生论坛卓越报告奖项,所参与的工作在2025年第85届美国糖尿病协会年会(ADA)以poster形式展出。主持2025年江苏省研究生科研创新计划项目,参与国家自然科学基金重点国际(地区)合作研究项目、面上项目、科技部高端外国专家引进计划等科研工作。
1. Vicious cycle-breaking lipid nanoparticles remodeling multicellular crosstalk to reverse liver fibrosis. Adv. Mater. 2024, 36: 2311474. (共一第一) IF = 27.4 权威期刊
2. Pathological microenvironment-remodeling nanoparticles to alleviate liver fibrosis: reversing hepatocytes-hepatic stellate cells malignant crosstalk. Adv. Sci. 2025, 12: 2408898. (共一第一) IF = 14.3 学科顶尖 封面文章
3. Sequential nano-penetrators of capillarized liver sinusoids and extracellular matrix barriers for liver fibrosis therapy. ACS Nano. 2022, 16: 14029-14042. (共一第一) IF = 17.1 学科顶尖
4. Spontaneous Inflammation Resolution Inspired Nanoparticles Promote Neutrophil Apoptosis and Macrophage Efferocytosis for Acute Respiratory Distress Syndrome Treatment. Adv. Healthc. Mater. 2024. (共一第二) IF = 10.0 学科一流
5. Progress on the pathological tissue microenvironment barrier-modulated nanomedicine. Adv. Drug. Deliver. Rev. 2023, 200: 115051. (共同作者) IF = 15.2 权威期刊
6. An autologous macrophage-based phenotypic transformation-collagen degradation system treating advanced liver fibrosis. Adv. Sci. 2023, 11: 2306899. (共同作者) IF = 14.3 学科顶尖
7. Dual inhibition of glucose uptake and energy supply synergistically restrains the growth and metastasis of breast cancer. Chin. Chem. Lett. 2022, 34: 107719. (共同作者) IF = 9.4 学科一流
8. 专利授权,第三发明人,一种调控肝窦内皮细胞的纳米载体及其制备方法和应用,China,申请号:202110171569.4
9. 专利公开,第二发明人,一种组合制剂及其应用,China,申请号:202311791791.X

