论文作者:董豪杰,指导教师:杨鹏
所属学院:药学院,二级学科:药物化学
01 导师说

自全球首例激酶抑制剂上市至今已有20多年的历史,其在临床靶向治疗中发挥了重要作用。同时耐药也是激酶抑制剂临床使用中的一大问题。而设计研发新一代激酶抑制剂便成了解决临床耐药问题的方法。第三代EGFR抑制剂奥希替尼便是克服了前两代药物的耐药性,成为了临床一线用药。随着临床出现部分奥希替尼耐药,设计研发更新一代的抑制剂便成了亟待解决的问题。
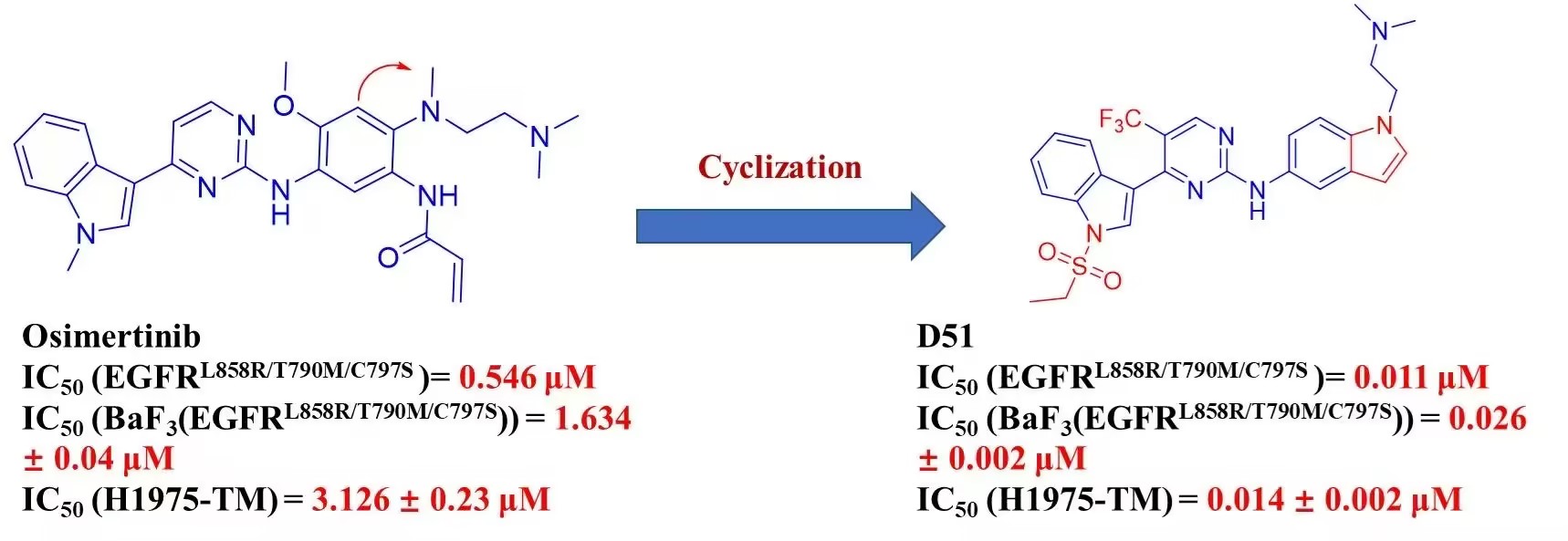
该课题从解决临床耐药的角度出发,以奥希替尼为先导,基于奥希替尼与EGFR的共晶结构,提出通过环化策略增加化合物与突变蛋白之间的相互作用,成功设计并合成一系列化合物。并在后续活性测试中展现了显著的体内与体外的抑制活性。同时,最优化合物在药物代谢动力学研究中展现了很好的成药性与安全性。该项研究提供了强效的第四代EGFR抑制剂,并为治疗奥希替尼耐药的非小细胞肺癌治疗提供了潜在的候选化合物。
02 作者说

作为非小细胞肺癌的主要治疗靶点,EGFR一直备受研究者的关注,目前已有多达三代共12种EGFR抑制剂被批准上市。这其中,第一代抑制剂主要针对EGFRL858R的常见致病性突变,第二代为共价抑制剂与第一代靶点相同。以奥希替尼为代表的第三代抑制剂主要针对前两代抑制剂的耐药性突变EGFRL858R/T790M,同时奥希替尼还可以抑制EGFR单突变。随着临床研究的进展,有一部分患者出现了奥希替尼耐药。奥希替尼耐药机制可以分为两种:EGFR依赖性耐药,即突变EGFR在接受治疗后产生了新的突变;非EGFR依赖性耐药,即体内其他信号通路或EGFR下游通路的激活。
EGFR依赖性耐药的主要突变为C797S,导致三突变蛋白EGFRL858R/T790M/C797S的产生。该课题便是以三突变蛋白为靶点,通过传统药物化学的方法设计出新的三突变EGFR抑制剂,从而达到解决临床耐药的问题。在课题初步阶段,我们确定上市药物奥希替尼为先导化合物,通过研究三突变蛋白与奥希替尼的共晶结构,设计了环化策略。后续在激酶活性的指导下,我们设计合成了几个系列化合物并探讨了其构效关系。在通过激酶活性与体外细胞活性筛选后,我们对最优化合物进行了体内抗肿瘤与成药性评价。
非EGFR依赖性耐药是与EGFR相关的信号通路的其他蛋白发生突变,包括MET突变,HER2突变和ALK融合重排等。而针对该耐药机制,主要策略是研发双靶或多靶抑制剂从而达到抑制相邻通路多个靶点的目的。
该项研究不仅提供了强效的第四代EGFR抑制剂候选化合物,同时也为临床耐药研究提供了新的选择。
03 硕士论文简介
EGFR是非小细胞肺癌靶向治疗的主要研究靶点,目前已有三代共12个EGFR抑制剂批准上市,其中,第三代抑制剂奥希替尼,已经成为EGFR突变阳性NSCLC的一线用药。但是临床治疗中,已经有部分病人对奥希替尼产生了获得性耐药,因此研发新一代的抑制剂解决奥希替尼耐药具有重大的临床意义。
在该论文中,作者以奥希替尼为先导化合物,利用合理药物设计,设计并合成了数十个衍生化合物。在后续生物活性测试中,利用激酶活性测试,体外抗肿瘤细胞筛选,化合物选择性测试等方法筛选出最优化合物。最优化合物在体内安全性测试,药代动力学测试及体内抗肿瘤测试中均有很好结果。该论文为解决奥希替尼耐药治疗提供了新的具有良好成药性及安全性的临床候选化合物,为解决临床问题提供了新的方法。
学术成果
董豪杰同学在攻读硕士研究生期间主要负责选择性EGFR抑制剂的设计,合成和抗癌活性研究,董豪杰以第一作者身份将该成果发表于药物化学TOP期刊 Journal of Medicinal Chemistry,并且该化合物的专利已申请国家专利(CN114380806B)和世界专利(WO2023178928A1)。董豪杰同学同时还参与了其他课题,包括HSP90抑制剂的设计合成,CDK抑制剂的合成与综述撰写,SET7抑制剂的合成,PD-1/PD-L1抑制剂的合成,并以共同作者身份在Acta Pharmaceutica Sinica B, Journal of Medicinal Chemistry和Bioorganic & Medicinal Chemistry上发表多篇论文。

