论文作者:刘定康,指导教师:高向东
所属学院:生命科学与技术学院,二级学科:生物学
01 导师说

本课题源于中国药科大学“双一流”建设项目与江苏省研究生科研与实践创新计划,旨在探索并设计针对肿瘤多药耐药(MDR)的有效方法。在以往失败的MDR临床案例中,研究者们往往只是针对某一种ABC转运体进行抑制剂的开发。然而,耐药过程中通常都有多种ABC转运体参与,相互之间还存在补偿性上调的现象,因此理想的ABC转运体抑制剂需要广谱的抑制活性。本课题采用了一种新型策略,通过破坏耐药肿瘤细胞的线粒体功能来克服多药耐药性。以具有破坏线粒体功能的生物活性肽R8-KLA为模式分子,与我们前期开发的一种人工定向设计的聚多肽PsTag进行融合,构建了一种长效、具有肿瘤靶向和响应释放的新型融合蛋白PAK。在随后的研究中,我们证实PAK可通过靶向损伤肿瘤细胞线粒体,降低胞内ATP水平,有效提高MDR肿瘤细胞对化疗药物的摄取和敏感性。由于需要ATP提供能量是所有ABC转运体发挥功能的共同前提,因此PAK在克服ABC转运体导致的肿瘤MDR中具有广泛的适用性。目前,融合蛋白PAK的设计、制备及其应用已申请中国国家发明专利(ZL201811632324.1)。此外,PAK可在原核表达系统中表达,产物组分均一,易于规模化制备及质量控制,具有良好的临床应用前景。
02 作者说

尽管近年来的生物疗法发展十分迅速,化疗仍然是许多类型癌症的最有效疗法。不幸的是,大多数接受化疗的癌症患者都会产生多药耐药(MDR)。持续的研究发现,几乎每种有效抗癌药,甚至包括新开发的药物,如广谱化疗药物和酪氨酸激酶抑制剂,都存在耐药的问题。针对该挑战,我们尝试从三个方面进行探索:
首先,我们为耐药实体瘤治疗提供了新的药物候选分子——融合蛋白PAK。针对耐药过程中ABC转运体参与广泛并存在补偿性上调的问题,PAK能够通过靶向损伤肿瘤细胞线粒体,降低胞内ATP水平,有效提升MDR肿瘤细胞对化疗药物的摄取和敏感性。由于ABC转运体发挥功能的前提是需要ATP提供能量,因此PAK在克服ABC转运体导致的肿瘤MDR方面具有一定的通用性。
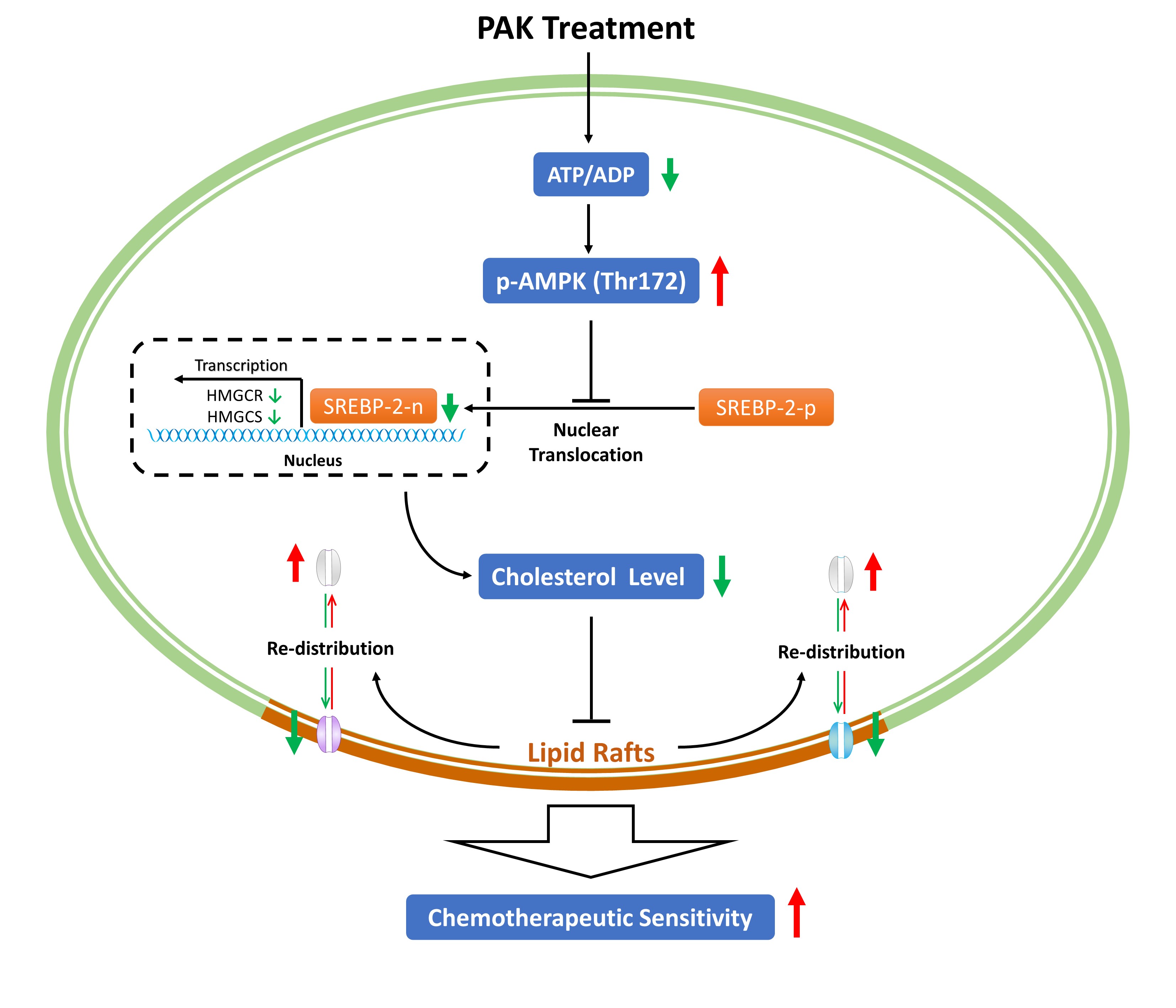
其次,本研究为克服肿瘤多药耐药提供了新的研究思路。耐药癌细胞相比敏感癌细胞更少依赖糖酵解途径获得能量,而主要依赖线粒体氧化磷酸化(OxPhos)来维持较高的ATP水平。我们发现PAK不仅能够抑制线粒体OxPhos降低ATP水平,还能改变ABC转运体在脂筏上的定位。这一发现揭示了一种耐药逆转模式,即通过药物破坏脂筏,降低ABC转运体在细胞膜上的分布,从而增强耐药细胞对化疗的敏感性。
最后,本研究提供了一种抗肿瘤多肽靶向递送的方法。虽然生物活性肽是针对内源性靶点的天然候选药物,但其体内半衰期短的问题限制了其临床应用。我们成功设计了一种融合蛋白PAK,将R8-KLA递送至肿瘤细胞内发挥其线粒体损伤活性。这一方法不仅为R8-KLA的递送提供了解决方案,还为其他抗肿瘤多肽的靶向递送提供了借鉴。但是,本论文也还存在一些不足之处。比如,融合蛋白PAK的产量较低,难以满足潜在的工业化需求。同时,样品保存条件、短期及长期保存稳定性等也需要进一步研究。其次,胆固醇调控脂筏的具体机制尚需进一步探索。虽然本研究证明了PAK通过下调胆固醇水平提高了MDR肿瘤细胞的化疗敏感性,并确认了胆固醇与ABC转运体再分布之间的调控关系,但胆固醇如何参与脂筏结构的维持并导致ABC转运体在脂筏上定位减少的具体机制尚不明确,有待进一步深入研究。
总之,我们发现PAK通过靶向线粒体抑制了细胞内胆固醇水平,导致MDR相关的ABC转运蛋白在脂筏区和细胞质之间重新分布。这些结果是一个激动人心的开始,证明了靶向线粒体在克服MDR方面的有效性。
03 博士论文简介
多药耐药(MDR)是肿瘤治疗的主要障碍。研究表明,肿瘤细胞的高能态与耐药性密切相关。因此,通过药物破坏线粒体可能是一种克服MDR的有效策略。本研究基于前期开发的聚多肽PsTag融合技术和肿瘤微环境的特点,提出构建“一种将线粒体损伤肽靶向递送至MDR肿瘤细胞以提高化疗敏感性”的设想。为了测试这一设想,我们采用一种经典的线粒体损伤肽R8-KLA作为我们的模式多肽,设计了一种融合蛋白PAK(PsTag-ACPP-KLA)。完整序列含有以下三个部分:216个氨基酸的PsTag聚多肽序列,可激活的细胞穿透肽(ACPP),以及具有线粒体损伤作用的多肽KLA。首先,我们构建了融合蛋白PAK的原核表达菌株,并对目的蛋白进行了诱导表达和纯化,成功得到了HPLC纯度大于95%的目的蛋白。进一步MMP2酶切鉴定结果显示,PAK在37℃处理4小时即可被MMP2完全消化。PAK还表现出良好的血清稳定性,且未检测出溶血毒性和免疫原性。进一步,PAK通过降低线粒体膜电位、激活线粒体凋亡通路的方式产生细胞毒性。MTT、克隆形成和肿瘤成球试验的结果共同显示,PAK可以有效提高MDR肿瘤细胞的化疗敏感性。机制上,PAK提高了胞内ROS的水平,降低了胞内NADH和ATP的水平。同时,PAK可以有效地内化到MCF7/Dox细胞中,且与线粒体高度共定位。进一步结果显示,PAK通过AMPK/SREBP2轴下调了胞内胆固醇的水平,从而诱导了ABC转运体从脂筏到胞内的转移。综上,我们提出了一种通过蛋白融合技术向肿瘤靶向递送线粒体损伤肽的策略,并基于该策略构建了融合蛋白PAK。同时,揭示了一种耐药逆转模式:线粒体损伤通过破坏脂筏,增强耐药癌细胞对化疗的敏感性,表明线粒体可能是逆转恶性肿瘤MDR的潜在靶点。
学术成果
1. Liu Dingkang#, Rong Haibo#, Chen Ye, Wang Qun, Qian Sijia, Ji Yue, Yao Wenbing*, Yin Jun*, Gao Xiangdong*. Targeted Disruption of Mitochondria Potently Reverses Multidrug Resistance in Cancer Therapy[J]. British Journal of Pharmacology, 2022, 179(13): 3346-3362. DOI: 10.1111/bph.15801.
2. Liu Dingkang#, Chen Ye#, Wang Qun, Ji Yue, Bao Lichen, Yao Wenbing*, Gao Xiangdong*, Yin Jun*. Tailored Protein-Conjugated DNA Nanoplatform for Synergistic Cancer Therapy[J]. Journal of Controlled Release, 2022, 346:250-259. DOI: 10.1016/j.jconrel.2022.04.022.
3. Yin Jun#, Liu Dingkang#, Bao Lichen, Wang Qun, Chen Ye, Hou Shan, Yue Yali, Yao Wenbing*, Gao Xiangdong*. Tumor targeting and microenvironment-responsive multifunctional fusion protein for pro-apoptotic peptide delivery[J]. Cancer Letters, 2019, 452: 38-50. DOI: 10.1016/j.canlet.2019.03.016.
4. Wang Qun, Yang Yifan, Liu Dingkang, Ji Yue, Gao Xiangdong*, Yin Jun*, Yao Wenbing*. Cytosolic protein delivery for intracellular antigen targeting using supercharged polypeptide delivery platform[J]. Nano Letters, 2021, 21 (14): 6022-6030. DOI: 10.1021/acs.nanolett. 1c01190.
5. Yin Jun#, Hou Shan#, Wang Qun, Bao Lichen, Liu Dingkang, Yue Yali, Yao Wenbing*, Gao Xiangdong*. Microenvironment-responsive delivery of the cas9 RNA-guided endonuclease for efficient genome editing[J]. Bioconjugate Chemistry, 2019, 30 (3): 898-906. DOI: 10.1021/acs.bioconjchem.9b00022.

